ģĒ«įőĽ÷√ > ◊Ūď > ľľ–g(sh®ī)őń’¬ > Vero ľöįŻ‘ŕ WAVE ∑īĎ™(y®©ng)∆ų÷–ĶńőĘ›důw«ÚřD(zhu®£n)«Ú∑Ňīů
Vero ľöįŻ‘ŕ WAVE ∑īĎ™(y®©ng)∆ų÷–ĶńőĘ›důw«ÚřD(zhu®£n)«Ú∑Ňīů
Vero ľöįŻ‘ŕ WAVE ∑īĎ™(y®©ng)∆ų÷–ĶńőĘ›důw«ÚřD(zhu®£n)«Ú∑Ňīů
ÍĎŻź∑ľ£¨Christain Kaisermayer, “¶‚ēňī£¨ňŚ∂YŻź
Õ®”√Žäö‚Št(y®©)ĮüľĮąF…ķ√ŁŅ∆ĆW≤Ņ£¨F(xi®§n)ast Trak—–įl(f®°)÷––ń£¨…Ōļ£
łŇ“™
Vero ľöįŻń‹ĪĽŹV∑ļĎ™(y®©ng)”√”ŕ“Ŗ√ÁĶń…ķģa(ch®£n)°£Vero ľöįŻĶńŇŗūB(y®£ng)ľľ–g(sh®ī)ń‹∑Ů≥…Ļ¶∑Ňīůƶ”ŕ‘ďľľ–g(sh®ī)ń‹∑Ůīů“é(gu®©)ń£Ď™(y®©ng)”√”ŕ“Ŗ√Á…ķģa(ch®£n)÷ŃÍP(gu®°n)÷ō“™°£◊ųěťŔNĪŕľöįŻ£¨ő“āÉĶńĹõ(j®©ng)Úě◊C√ųVero ľöįŻń‹ČÚ≥…Ļ¶Ķō”√őĘ›důwľľ–g(sh®ī)‘ŕ WAVE ∑īĎ™(y®©ng)∆ų÷–…ķťL°£ěťŃňŖM“Ľ≤ĹƧ«ů∑ŇīůŇŗūB(y®£ng)ĶńŅ…ń‹–‘£¨ő“āÉ‘ŕ WAVE ∑īĎ™(y®©ng)∆ų÷–ŖM––ŃňľöįŻŹńőĘ›důw Cytodex 1 …ŌĶń«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě°£“ĽŌĶŃ–ĶńĆćÚě∂ľŌŗģĒ≥…Ļ¶°£VeroľöįŻ ◊Ō»‘ŕ 10 LĶńŇŗūB(y®£ng)īŁ÷–”√Cytodex 1őĘ›důwŇŗūB(y®£ng)ĶĹ“Ľ∂®√‹∂»£¨…ķťL‘ŕőĘ›důw…ŌĶńľöįŻŽSļů”√“»Ķįį◊√łŌŻĽĮ£¨Ĺõ(j®©ng)ŌŻĽĮļůĽýĪĺ√ďŽxőĘ›důwĶńľöįŻ◊ÓĹKļÕŇfĶńőĘ›důwłýďĢ(j®ī)“Ľ∂®Ķńāųīķ√‹∂»řD(zhu®£n)“∆ĶĹ–¬ĶńőĘ›důwŇŗūB(y®£ng)ůwŌĶ÷–≤Ęť_ ľ–¬“Ľ›ÜľöįŻŇŗūB(y®£ng)°£ő“āÉĶńĹY(ji®¶)ĻŻÔ@ ĺ£¨é◊īőŖ@ė”ĶńřD(zhu®£n)“∆āųīķ«įļů£¨ľöįŻĶń…ķťLňŔ∂»ĽýĪĺ“Ľ÷¬°£Vero ľöįŻĶńőĘ›důwŇŗūB(y®£ng)ľľ–g(sh®ī)‘ŕ WAVE ∑īĎ™(y®©ng)∆ų÷–∑ŇīůÕÍ»ęŅ…ń‹°£ŖM“Ľ≤ĹĶńĆćÚěÔ@ ĺ£¨‘ŕ¨F(xi®§n)”–ĶńĻ§◊ųólľĢŌ¬£¨VeroľöįŻ‘ŕ Cytodex …ŌĶńŇŗūB(y®£ng)“‘ľį«ÚřD(zhu®£n)«ÚĻ§ňáŅ…“‘Ŗ_ĶĹ 10 Ī∂Ķń∑ŇīůĪ∂¬ °£Ŗ@일ý”ŕľöįŻŇŗūB(y®£ng)Ķń“Ŗ√Áīů“é(gu®©)ń£Ļ§ėI(y®®)ĽĮ…ķģa(ch®£n)–¬«įĺįŐŠĻ©ŃňŅ…ŅŅĶń÷ß≥÷°£
«į—‘
VeroľöįŻ◊Ó≥ű∆ū‘ī”ŕ∑«÷řĺGļÔńI£¨“—÷™Ć¶∂ŗ∑N≤°∂ĺ»Á SV40°Ę SV-5°Ę ¬ť’Ó≤°∂ĺ°ĘŌx√Ĺ≤°∂ĺ°ĘļŰőŁĶņńcĶņ≤°∂ĺ°ĘÔL’Ó°Ę‘≥ŌŔ≤°∂ĺ°ĘľĻňŤĽ“Ŕ|(zh®¨)—◊≤°∂ĺ°ĘŃųł–≤°∂ĺ°ĘłĪŃųł–≤°∂ĺ°ĘŇ£∂Ľ≤°∂ĺĶ»Ķ»£¨∂ľ√Űł–°£Vero ľöįŻ“Ú∂ÝĪĽŹV∑ļĎ™(y®©ng)”√”ŕŠėƶŌŗĎ™(y®©ng)ľ≤≤°Ķń“Ŗ√Áť_įl(f®°)[1]°£◊ÓĹŁŠėƶŃųł–“Ŗ√ÁĶńť_įl(f®°)ĺÕ Ļ”√ĶĹŃň Vero ľöįŻ[2]°£÷™√ŻĶń÷∆ňé∆ůėI(y®®)įŔŐōĻęňĺ£®Baxter Healthcare)≥…Ļ¶ņŻ”√ Cytodex3 –ÕőĘ›důwŖM–– Vero ľöįŻŃųł–“Ŗ√ÁĶń…ķģa(ch®£n)£¨ Ļ”√ 3 ľČ≤ĽÕ¨Ķńįl(f®°)ĹÕĻřŖM––őĘ›důw«ÚřD(zhu®£n)«ÚĒU‘Ų£¨◊ÓĹK÷Ń 6000L ∑īĎ™(y®©ng)∆ųĶńŇŗūB(y®£ng)“é(gu®©)ń£°£÷Z»AĻęňĺ“≤‘Á“—‘ŕ∆šöW÷řĶńľöįŻŇŗūB(y®£ng)Ļ§ŹS÷–Ķ√ĶĹ‘SŅ… Ļ”√ľöįŻ“Ŗ√Á…ķģa(ch®£n)ľľ–g(sh®ī)°£÷Z»AĻęňĺ◊ÓĹŁŇc√ņáÝ–l(w®®i)…ķŇcĻęĻ≤∑ĢĄ’(w®ī)≤Ņ£®HHS)Ŗ_≥…Öf(xi®¶)◊h£¨ļů’ŖŔĚ÷ķ«į’Ŗ 4.86 É|√ņ‘™‘ŕĪĪŅ®Ń_ĀŪń«Ĺ®ŃĘ≤ł»ťĄ”őÔľöįŻ“Ŗ√Á…ķģa(ch®£n)ĽýĶō£¨”čĄĚ 2012 ńÍÕ∂»Ž Ļ”√[3]°£ľöįŻ“Ŗ√Áľľ–g(sh®ī)£¨ĺŖ”–ŅžňŔļÕŅ…ŅŅĶńŐō’ų£¨◊ųěť»ę«Úįl(f®°)’ĻĶńīůŕÖĄ›£¨ĆĘ”–ÕŻ÷ū≤ĹŐśīķńŅ«įĶńŽuŇŖ“Ŗ√Áľľ–g(sh®ī)°£
◊ųěťŔNĪŕľöįŻ£¨Vero ľöįŻ–Ť“™…ķťL”ŕ“Ľ∂®ĶńĪŪ√ś£¨‘ŕ–°“é(gu®©)ń£†ÓĎB(t®§i)Ō¬Ņ…“‘”√ T –ÕŇŗūB(y®£ng)∆ŅĽÚĚL∆ŅĀŪŖM––ŇŗūB(y®£ng)°£áÝÉ»(n®®i)őĘ›důwľöįŻŇŗūB(y®£ng)ňģ∆ĹļÕáÝÕ‚≤Óĺŗ›^īů£¨∂ŗĒĶ(sh®ī)»‘ Ļ”√řD(zhu®£n)∆Ņ/ľöįŻĻ§ŹS÷ĪŔŔ∑NĶĹ 30L įl(f®°)ĹÕĻř÷–£¨≤…”√∂ŗāÄ 30L įl(f®°)ĹÕĻř∆Ĺ––∑Ňīů≤Ŕ◊ų°£řD(zhu®£n)∆ŅŇŗūB(y®£ng)ĆŔ”ŕĄŕĄ”√‹ľĮ–Õ≤Ŕ◊ų£¨üo∑®Ć¶ pH°Ę»‹—űĶ»ÖĘĒĶ(sh®ī)ŖM––ĺę√‹Ņō÷∆£¨Õ¨ērĺŖ”–›^łŖĶńőŘ»ĺÔLŽU°£∂ŗāÄ–°–Õįl(f®°)ĹÕĻřĶń∆Ĺ––∑Ňīůüo∑®Ī‹√‚√ŅāÄ∑īĎ™(y®©ng)∆ų÷ģťgĶń≤Óģź£¨‘Ųľ”Ńň…ķģa(ch®£n)Ŗ^≥ŐĶńŅō÷∆Łc£¨≤ĽņŻ”ŕģa(ch®£n)∆∑Ŕ|(zh®¨)ŃŅĶń∑Ä(w®ßn)∂®–‘ļÕ’ŻāÄ…ķģa(ch®£n)Ļ§ňáĶńÚě◊C£¨Ōř÷∆Ńňģa(ch®£n)ń‹°£
“Úīň–Ť“™ť_įl(f®°)īů“é(gu®©)ń£őĘ›důwľöįŻŇŗūB(y®£ng)ľľ–g(sh®ī)“‘ĚM◊„…ķőÔľľ–g(sh®ī)įl(f®°)’ĻĶń–Ť“™£¨∂ÝőĘ›důw«ÚřD(zhu®£n)«Ú∑ŇīůĻ§ňáĺÕ «∆š÷–ĶńÍP(gu®°n)śIŁc÷ģ“Ľ[4,5]£¨“‘Ī„‘ೣīůĶńĻ§ėI(y®®)“é(gu®©)ń£ŖM––ŇŗūB(y®£ng)ļÕ…ķģa(ch®£n)°£ļ‚ŃŅŖ@“Ľľľ–g(sh®ī) «∑Ů≥…Ļ¶, “Ľ∑Ĺ√śĻŐ»Ľ «řD(zhu®£n)“∆ «∑Ů≥…Ļ¶£¨Õ¨ė”÷ō“™ĶńŃŪ“Ľ∑Ĺ√śĄt «řD(zhu®£n)“∆ļůľöįŻ «∑Ůń‹”–Õ¨ė”Ķń…ķťL†ÓĎB(t®§i)°£
∑Ĺ∑®
WAVETM ∑īĎ™(y®©ng)∆ų÷– Vero ľöįŻĶńŇŗūB(y®£ng)
‘ŕ10…żĶńľöįŻŇŗūB(y®£ng)īŁ÷–£¨Vero‘ŕőĘ›důw Cytodex 1 (Cyt.1)…ŌŔNĪŕŇŗūB(y®£ng)£¨őĘ›důwĚ‚∂» « 3-6g/L,Ď“ł°ŇŗūB(y®£ng)ůw∑e 1.5-3L°£‘ŕĹ”∑N«į“ĽŐž£¨ľöįŻŇŗūB(y®£ng)īŁÓA(y®ī)Ō»ĪĽ∑Ň÷√ĶĹWAVETM ∑īĎ™(y®©ng)∆ų…Ō£¨≥šĚM 10% CO2,≤Ęľ”»Ž 70-90%ŇŗūB(y®£ng)ůw∑eňý–ŤĶńŇŗūB(y®£ng)“ļ“‘ľįőĘ›důw£¨≤Ę‘ŕ 37°„C ďuĄ”Ŗ^“Ļ“‘Ī„ Ļúō∂»ļÕ pH Ķ√ĶĹ≥š∑÷∆Ĺļ‚°£Ĺ”∑NģĒŐž£¨”√“»√łį—ľöįŻŹńľöįŻĻ§ŹS÷–ŌŻĽĮŌ¬ĀŪ£¨÷ō–¬Ď“ł°”ŕ–¬űrĶńŇŗūB(y®£ng)Ľý÷–≤ĘřD(zhu®£n)“∆ĶĹÓA(y®ī)Ō»∆Ĺļ‚ĶńľöįŻŇŗūB(y®£ng)īŁ÷–£¨ľöįŻĹ”∑N√‹∂»Ņō÷∆‘ŕ√ŅļŃ…ż 3-5x105āÄľöįŻ°£ŇŗūB(y®£ng)ólľĢ «£¨ďuňŔ 11 rpm£¨Ĺ«∂» 4 ∂»£¨úō∂» 37°„C°£pH Ņō÷∆‘ŕ 7.0-7.3 ÷ģťg°£łýďĢ(j®ī)∆ŌŐ—Ő«Ķńīķ÷x«ťõrŖmērÕ®Ŗ^”√–¬űrŇŗūB(y®£ng)“ļŐśďQŇŗūB(y®£ng)īŁÉ»(n®®i)ĶńŇŗūB(y®£ng)“ļĀŪ—a≥š†IūB(y®£ng)°£√ŅŐž≤…ė”ĪO(ji®°n)úyľöįŻ…ķťLňŔ∂»ļÕ†ÓĎB(t®§i)°£
ľöįŻ”čĒĶ(sh®ī)Ķń∑Ĺ∑® «£¨”√ļ¨ôé√ ňŠĶńĹY(ji®¶)ĺß◊Ō»ĺ…ę“ļ∆∆ňťľöįŻ£¨ŠĆ∑Ň≤Ę»ĺ…ęľöįŻļň£¨Õ®Ŗ^‘ŕÔ@őĘÁRŌ¬”čĒĶ(sh®ī)ľöįŻļňĀŪī_∂®ľöįŻĶńĒĶ(sh®ī)ŃŅ°£őĘ›důw…ŌĶńľöįŻ–őĎB(t®§i)ĄtÕ®Ŗ^ĻŐ∂®£¨ŐKńĺňō»ĺ…ęļÕÔ@őĘÁRĀŪ”^≤ž≤Ę’’Ōŗ°£ľöįŻ√‹∂»Ŗ_ĶĹľs√ŅļŃ…ż2-3x106āÄēr£¨ŖM––«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě°£√Ņīő«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěļů£¨ľöįŻ‘ŕWAVETM ∑īĎ™(y®©ng)∆ųÉ»(n®®i)”√…Ō ŲÕ¨ė”Ķń∑Ĺ∑®ŖM––ĒĶ(sh®ī)ŐžĶńŇŗūB(y®£ng)£¨”^≤ž…ķťL†Óõr°£
‘ŕ∆Ņ◊”É»(n®®i)ŖM––«ÚřD(zhu®£n)«Ú?q®Ī)ćÚ?/STRONG>
‘ŕ WAVETM ∑īĎ™(y®©ng)∆ųÉ»(n®®i)ľöįŻ√‹∂»Ŗ_ĶĹ–Ť“™Ķńňģ∆Ĺēr£¨Vero ľöįŻőĘ›důwŇŗūB(y®£ng)Ď“ł°“ļľīĪĽřD(zhu®£n)“∆ĶĹŃŪÕ‚“ĽāÄÕł√ųĶń∆Ņ◊”÷–≤Ę“∆ĶĹ…ķőÔį≤»ęĻŮ÷–°£ļů√śĶń«ŚŌīļÕ“»√łŌŻĽĮŖ^≥ŐĶ»ĺý‘ŕ…ķőÔį≤»ęĻŮÉ»(n®®i)ŖM––°£‘ŕőĘ›důw≥ŃĹĶŌ¬ĀŪ÷ģļů£¨»•≥ż…Ō«Ś°£ £Ō¬ĶńőĘ›důwĪĽřD(zhu®£n)“∆ĶĹ 500 ļŃ…żüoĺķÕł√ųĶń∆Ņ◊”É»(n®®i)£®Ŗ@ «łýďĢ(j®ī) 2 …żŇŗūB(y®£ng)ůw∑eňý–ŤĶń∆Ņ◊”īů–°£¨≤ĽÕ¨Ķń«ťõrĎ™(y®©ng)”–≤ĽÕ¨Ķń–Ť«ů£©°£ĪMŃŅ∂ŗĶō»•≥ż…Ō«Ś°£ľ”»Ž 400 ļŃ…ż 37°„C ÓA(y®ī)üŠĶńļ¨ 0.02% EDTA Ń◊ňŠĺŹõ_“ļ (PBS-EDTA), ŖmģĒĽžļŌ£¨īżőĘ›důw≥ŃĹĶļů»•≥ż…Ō«Ś°£“‘…ŌÕ¨ė”ĶńŖ^≥Ő÷ōŹÕ(f®ī) 3īő“‘ ĻőĘ›důwĶ√ĶĹ≥š∑÷Ōīúž°£
ťL”–ľöįŻĶńőĘ›důw‘ŕ”√ PBS-EDTA ≥š∑÷Ōīúž÷ģļů£¨ľī”√ļ¨ 0.02% EDTA Ķń 0.25%“»√łŌŻĽĮ°£2 …żĶńŇŗūB(y®£ng)ůw∑e£®6 ŅňőĘ›důw£©£¨“»√ł”√ŃŅěť 300 ļŃ…ż°£“»√łÓA(y®ī)Ō»‘ŕ37°„C ÓA(y®ī)üŠ£¨‘ŕŇcőĘ›důwĽžļŌ÷ģļů÷√”ŕ 37°„C ÷–≤Ę√ŅłŰ 10 ∑÷ÁäŖM––“Ľīő≥š∑÷ĶńĽžļŌ°£25-30 ∑÷Áä÷ģļů£¨łýďĢ(j®ī)ňý–Ť“™ĶńĹ”∑N√‹∂»ļÕŌ°ŠĆĪ∂ĒĶ(sh®ī)£¨»°“Ľ≤Ņ∑÷ľöįŻ-őĘ›důw-“»√łĽžļŌĎ“ł°“ļĶĹ“ĽāÄł…ÉŰĶńüoĺķřD(zhu®£n)“∆∆ŅÉ»(n®®i)£¨Ňc–¬űrŇŗūB(y®£ng)ĽýĽžļŌ≤ĘĹ”∑NĶĹ“ĽāÄ–¬ĶńŇŗūB(y®£ng)īŁ÷–ť_ ľ–¬“Ľ›ÜĶńŇŗūB(y®£ng)°£‘ŕ WAVETM ŇŗūB(y®£ng)īŁÉ»(n®®i)ŖM––«ÚřD(zhu®£n)«Ú?q®Ī)ćÚ?
‘ŕ WAVETM ∑īĎ™(y®©ng)∆ųÉ»(n®®i)ľöįŻ√‹∂»Ŗ_ĶĹ–Ť“™Ķńňģ∆Ĺēr£¨«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě‘?WAVETM ŇŗūB(y®£ng)īŁÉ»(n®®i)ŖM––°£ĆćÚěť_ ľ«į£¨ú āš—b”– 5-10 …ż PBS-EDTA Ķń“ļůwřD(zhu®£n)“∆∆ŅļÕ»‹∑e 5-10 …żĶńŹU“ļ∆Ņ£¨úÁĺķ°£ú āš 1 …żĶń“ļůwřD(zhu®£n)“∆∆ŅÉ…āÄ£¨úÁĺķ£¨≤Ę‘ŕüoĺķólľĢŌ¬∑÷Ąe—b»Ž“»√łļÕ–¬űrŇŗūB(y®£ng)Ľý°£ĆĘ PBS-EDTA£¨“»√łļÕ–¬űrŇŗūB(y®£ng)Ľý∑÷ĄeÓA(y®ī)üŠ÷Ń 37°„C°£
‘ŕüoĺķólľĢŌ¬£®»ÁüoĺķĻ‹ĶņļłĹ”ôC£©ĆĘŖ@é◊āÄ∆Ņ◊”ŇcľöįŻŇŗūB(y®£ng)īŁĹ”Õ®°£’ŻāÄĆćÚěŖ^≥Ő÷–ľöįŻŇŗūB(y®£ng)īŁĺýĪĽ÷√”ŕ∑īĎ™(y®©ng)∆ų…Ō°£∑īĎ™(y®©ng)∆ųÕ£÷ĻďuĄ”≤ĘÕ£÷Ļľ”üŠ“‘∑ņŖ^üŠĽÚ≤ĽĺýĄÚľ”üŠ°£ŇŗūB(y®£ng)īŁÉ»(n®®i)ťL”– Vero ľöįŻĶńőĘ›důwēĢ‘ŕĒĶ(sh®ī)∑÷ÁäÉ»(n®®i)≥ŃĶĹĶ◊≤Ņ°£”√Ī√į—ĪMŃŅ∂ŗĶń…Ō«Ś“ļ“∆÷ŃŹU“ļ∆Ņ°£ľ”»Ž“Ľ∂®ŃŅĶń PBS-EDTA£¨›p»ŠĽžĄÚļů£¨‘Ŕīő≥ŃĹĶőĘ›důw≤Ę“∆»•…Ō«Ś°£»Áīň÷ōŹÕ(f®ī)»żīő£¨√Ņīő Ļ”√ PBS-EDTA ĶńŃŅ≤Ľ≥¨Ŗ^“ĽāÄŇŗūB(y®£ng)ůw∑e°£
ťL”–ľöįŻĶńőĘ›důw‘ŕ”√ PBS-EDTA ≥š∑÷Ōīúž÷ģļů£¨Ňc 37°„C ÓA(y®ī)üŠĶńļ¨ 0.02% EDTA Ķń 0.25%“»√łĽžļŌ£¨‘ŕőĘ›důw√‹∂»ěť 3g/L ēr£¨“»√łĶń”√ŃŅěť 15%ŇŗūB(y®£ng)ůw∑e°£“»√łĶń”√ŃŅŅ…łýďĢ(j®ī)ĆćŽH«ťõr◊ų’{(di®§o)’Ż°£ľ”»Ž“»√łļůĶńĽžļŌ“ļ√Ņ 10 ∑÷Áä›p»ŠďuĄ”ĽžļŌ“Ľīő°£25-30 ∑÷Áäļů£¨ľöįŻŇŗūB(y®£ng)īŁÉ»(n®®i)ĶńĎ“ł°“ļĪĽřD(zhu®£n)“∆÷Ń“ĽāÄŅ’ĶńüoĺķřD(zhu®£n)“∆∆ŅÉ»(n®®i)°£”√…ŔŃŅ–¬űrŇŗūB(y®£ng)“ļŃ‹ŌīŇŗūB(y®£ng)īŁ“Ľīő≤ĘļÕ«į√śĶńļŌ≤Ę°£łýďĢ(j®ī)ňý–Ť“™ĶńĹ”∑N√‹∂»ļÕŌ°ŠĆĪ∂ĒĶ(sh®ī)£¨Ĺ”∑N–¬ĶńľöįŻŇŗūB(y®£ng)īŁ≤Ęť_ ľ–¬“Ľ›ÜŇŗūB(y®£ng)°£
ĹY(ji®¶)ĻŻ
‘ŕľöįŻŇŗūB(y®£ng)īŁ÷–ļÕÕ‚≤Ņ∆Ņ◊”÷–ŖM––Ķń«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěĹY(ji®¶)ĻŻĪ»›^
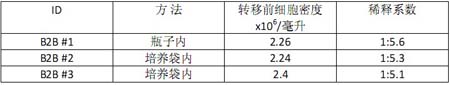
Ŗ@ņÔ”–»żīő«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě£®B2B #1, #2, #3)°£∆š÷–“Ľīő«ÚřD(zhu®£n)«Ú?q®Ī)ćÚ?B2B #1)‘ŕŇŗūB(y®£ng)īŁÕ‚Ķń∆Ņ◊”÷–ŖM––£¨ŃŪÉ…īő(B2B #2 ļÕ#3)‘ŕ WAVETM ŇŗūB(y®£ng)īŁÉ»(n®®i)ŖM––°£Ķŕ“Ľīő£®B2B #1)ļÕĶ໿īő(B2B #3)ĆćÚěĶń Vero ľöįŻĀŪ◊‘Õ®Ŗ^ľöįŻĻ§ŹSĹ”∑NĶĹŇŗūB(y®£ng)īŁ÷–≤Ę…ķťL∆ūĀŪĶńľöįŻ£¨∂ÝĶŕ∂ĢīőĆćÚě (B2B #2)Ķń Vero Ąt÷ĪĹ”ĀŪ◊‘Ķŕ“Ľīő«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěļůĹ”∑N≤ĘŇŗūB(y®£ng)∆ūĀŪĶńľöįŻ°£Ŗ@é◊īőĆćÚěő“āÉĺý «‘ŕľöįŻ√‹∂»≥¨Ŗ^ 2x106ērŖM––«ÚřD(zhu®£n)«Ú£¨≤Ęį—
∑ŇīůĪ∂ĒĶ(sh®ī)Ņō÷∆‘ŕ 5-6 Ī∂°£ĪŪ 1 Ń–ŇeĶń «Ŗ@»żīőřD(zhu®£n)“∆Ķńīů÷¬«ť–ő°£‘ŕĶŕ“ĽīőřD(zhu®£n)“∆÷ģ«į£¨ľöįŻ ◊Ō»ŹńľöįŻĻ§ŹSĹ”∑NĶĹ 10 …żĶńŇŗūB(y®£ng)īŁÉ»(n®®i)≤ĘŇŗūB(y®£ng)…ķťLĶĹňý–Ť“™ĶńľöįŻ√‹∂»°£Ĺõ(j®©ng)Ŗ^«ÚřD(zhu®£n)«Ú÷ģļůĶńľöįŻŇŗūB(y®£ng)“≤ «‘ŕ 10…żĶńŇŗūB(y®£ng)īŁÉ»(n®®i)ŖM––°£
ĪŪ1.łųīő«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě«ťõr
√Ņīő«ÚřD(zhu®£n)«Ú«įļůĶńľöįŻ…ķťL«ťõr∂ľÕ®Ŗ^√ŅŐž≤…ė”ĀŪĪO(ji®°n)úy°£ąD 1 ļÕąD 2 Ô@ ĺĶńĺÕ «łýďĢ(j®ī)√ŅīőŇŗūB(y®£ng)√ŅŐžľöįŻ√‹∂»Ķń‘ŲťL«ťõrņL÷∆ĶńľöįŻ…ķťL«ķĺÄ°£ő“āÉį—ŌŗÍP(gu®°n)¬ď(li®Ęn)Ķń∑Ň‘ŕ“Ľ∆ū◊ŲĪ»›^°£∆š÷–ąD 1 Ô@ ĺĶń « B2B #1°ĘB2B #2 ÷ģ«įļÕ÷ģļůľöįŻ…ķťL«ķĺÄ£¨∂ÝąD 2 ĄtÔ@ ĺĶń B2B #3 ÷ģ«įľį÷ģļůĶńľöįŻ…ķťL«ťõr°£ő“āÉŅ…“‘ŅīĶĹ‘ŕłųīő«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě«įļů£¨ľöįŻ∂ľĪ£≥÷÷ÝŃľļ√Ķń…ķťLĽÓѶ°£‘ŕ«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě÷ģļů£¨“Ú∆ū ľľöįŻ√‹∂»ŌŗĪ»≥ű ľ∑N◊”ŇŗūB(y®£ng)Ķń…‘ĶÕ£¨“Úīň–Ť“™∂ŗ“ĽŐžērťgŖ_ĶĹŌŗň∆ĶńľöįŻ√‹∂»°£ŅāůwĀŪ’f£¨ľöįŻ…ķťLĶńňŔ∂»ĽýĪĺŌŗÕ¨°£
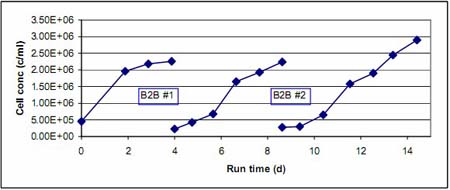
ąD1.«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěB2B #1ļÕ B2B #2«įļůľöįŻ…ķťL«ķĺÄ
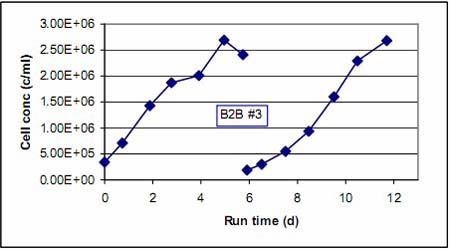
ąD2.«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěB2B #3«įļůľöįŻ…ķťL«ķĺÄ
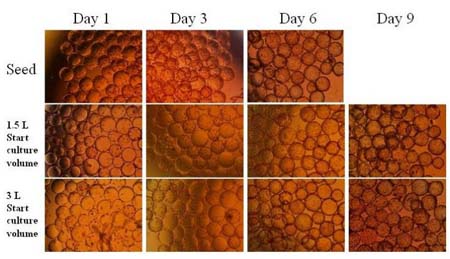
ąD 3 ļÕąD 4 Ô@ ĺĶń ««ÚřD(zhu®£n)«Ú«įļů Vero ľöįŻ‘ŕőĘ›důw…ŌĶń…ķťL«ťõr£¨∑÷Ąe”–Ĺ”∑N«įĶŕ“Ľ°ĘĶ໿ļÕĶŕőŚŐžľöįŻĶń–őĎB(t®§i)°£ąD 4 Ķń…Ō√ś»żŹą–°ąDÔ@ ĺŃň«ÚřD(zhu®£n)«Ú?q®Ī)ćÚ?B2B #3 ÷ģ«įĀŪ◊‘ľöįŻĻ§ŹS∑N◊”ŇŗūB(y®£ng)ĶńľöįŻ…ķťL–őĎB(t®§i)°£Ŗ@ «Ķš–ÕĶń Vero ľöįŻ∑N◊”ŇŗūB(y®£ng)Ķń…ķťL«ťõr°£Õ®≥£ 90%“‘…ŌĶń VeroľöįŻēĢ‘ŕĹ”∑N 4 –°ēr÷ģÉ»(n®®i)ŔNĶĹőĘ›důw…Ō≤Ę‘ŕ 24 –°ērÉ»(n®®i)ŖM»ŽĆ¶ĒĶ(sh®ī)…ķťL∆ŕ°£ŹńąD 3 ļÕąD 4 ÷–łųīő«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě÷ģļ?Vero ľöįŻ‘ŕőĘ›důw…ŌĶń…ķťL«ťõr£¨Ņ…“‘ŅīĶĹ«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě÷ģļůľöįŻĪ£≥÷”–Ńľļ√ĶńļÕ∑N◊”ľöįŻŇŗūB(y®£ng)Ōŗň∆Ķń…ķťL–őĎB(t®§i)°£
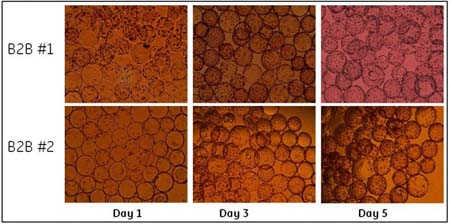
ąD 3.«ÚřD(zhu®£n)«Ú?q®Ī)ćÚ?B2B #1ļÕB2B #2ļů VeroľöįŻ‘ŕőĘ›důw…ŌĶń…ķťL«ťõr
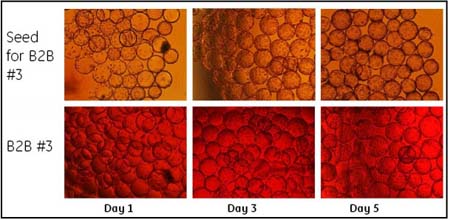
ąD4.«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěB2B #3«įļů VeroľöįŻ‘ŕőĘ›důw…ŌĶń…ķťL«ťõr
‘ŕľöįŻŇŗūB(y®£ng)īŁ÷–ŖM––ĶńłŖĪ∂¬ ∑Ňīů
ő“āÉÕ®Ŗ^É…∑N∑Ĺ ĹáL‘áį—«ÚřD(zhu®£n)«Ú∑ŇīůĻ§ňáĶń∑ŇīůĪ∂¬ ŐŠ…żĶĹ ģĪ∂°£Ķŕ“Ľ∑N «”√ 6 g/L ĶńőĘ›důw√‹∂»ŇŗūB(y®£ng) Vero ľöįŻ÷Ń 4x106/ļŃ…ż◊ů”“ĶńľöįŻ√‹∂»°£«ÚřD(zhu®£n)«Ú“‘ļů“‘ ģĪ∂Ķń∑ŇīůĪ∂ĒĶ(sh®ī)£®ŇŗūB(y®£ng)ůw∑e∑Ňīů£¨őĘ›důwĪŪ√ś∑e∑Ňīů£¨ĽÚ’ŖÉ…’ŖľśĺŖ£©ť_ ľ–¬“Ľ›ÜĶńŇŗūB(y®£ng)°£Ķŕ∂Ģ∑N «»Á…Ō“‘ 3g/L ĶńőĘ›důw√‹∂»ŇŗūB(y®£ng)£¨īżľöįŻ√‹∂»Ĺ”ĹŁ 3x106
ēr£¨ŖM––«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě£¨≤Ę≤…”√ŇŗūB(y®£ng)ůw∑eļÕőĘ›důwĪŪ√ś∑eĺýěť ģĪ∂Ķń∑ŇīůĪ∂¬ °£ěťŹõ—a∆ū ľľöįŻ√‹∂»Ŗ^ĶÕŅ…ń‹ēĢéßĀŪĶń…ķťL召ż£¨ő“āÉáL‘á‘ŕ«ÚřD(zhu®£n)«Ú÷ģļů”√›^…ŔĶńŇŗūB(y®£ng)ůw∑eŇŗūB(y®£ng)°£īżľöįŻĒĶ(sh®ī)‘ŲťLĶĹ“Ľ∂®≥Ő∂»ēr£¨‘ŔŐŪ—a–¬ĶńŇŗūB(y®£ng)ĽýĶĹ–Ť“™Ķńůw∑e°£”^≤ž«ÚřD(zhu®£n)«Ú«įļůĶńľöįŻ…ķťL«ťõr°£
B2B #4 ≤…”√Ķŕ“Ľ∑N∑Ĺ ĹŖM––łŖĪ∂¬ ∑Ňīů£¨ľī”√ 6g/L ĶńőĘ›důw√‹∂»ŇŗūB(y®£ng) VeroľöįŻ÷ŃľöįŻ√‹∂» 4.3x106/ļŃ…ż,ŇŗūB(y®£ng)ůw∑eěť 2 …ż°£”√“»√łį— Vero ľöįŻŹńőĘ›důw…ŌŌŻĽĮŌ¬ĀŪ°£»° ģ∑÷÷ģ“ĽĶńľöįŻ/őĘ›důwĎ“ł°“ļĹ”∑NĶĹ–¬Ķń 2 …żĶńŇŗūB(y®£ng)ůw∑e÷–£¨őĘ›důwĚ‚∂»ěť 6g/L,Ŗ@ė”ŇŗūB(y®£ng)ůw∑eľįőĘ›důwĪŪ√ś∑eĶń∑ŇīůĪ∂ĒĶ(sh®ī)ĺý « ģĪ∂°£◊ųěť∆Ĺ––Ī»›^‘áÚě£¨»° ģ∑÷÷ģ“ĽĶńľöįŻ/őĘ›důwĎ“ł°“ļĹ”∑NĶĹŃŪ“ĽāÄ 2 …żĶńŇŗūB(y®£ng)ůw∑e÷–£¨őĘ›důwĚ‚∂» 3 g/L,»ÁīňŇŗūB(y®£ng)ůw∑e∑Ňīů ģĪ∂£¨őĘ›důwĪŪ√ś∑e∑ŇīůőŚĪ∂°£É…āÄŇŗūB(y®£ng)Õ¨ērŖM––£¨”^≤žľöįŻ…ķťLĶń«ťõr°£
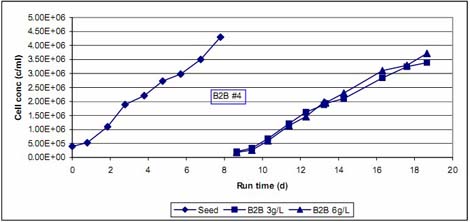
ąD5.«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěB2B #4«įļůľöįŻ…ķťL«ķĺÄ
ąD 5Ô@ ĺĶń ««ÚřD(zhu®£n)«Ú?q®Ī)ćÚěB2B #4«įļůľöįŻ…ķťL«ķĺÄ°£”–“‚ňľĶń ««ÚřD(zhu®£n)«Ú“‘ļůĶńÉ…āÄ∆Ĺ––ŇŗūB(y®£ng)÷–ľöįŻ‘ŲťLňŔ∂»ĽýĪĺŌŗň∆£¨Žm»Ľ∆šőĘ›důw√‹∂»Ōŗ≤ÓŃň“ĽĪ∂°£ňŁāÉĪ»∑N◊”ŇŗūB(y®£ng)∂ŗ”√Ńň 1-2 ŐžŖ_ĶĹŌŗň∆ĶńľöįŻ√‹∂»°£Ŗ@Ď™(y®©ng)‘ď ««ÚřD(zhu®£n)«Ú÷ģļůŇŗūB(y®£ng)Ķń∆ū ľľöįŻ√‹∂»Ōŗƶ›^ĶÕňý÷¬£¨ĶęľöįŻĪ∂‘ŲňŔ∂»≤Ę≤ĽĶÕ°£«ÚřD(zhu®£n)«Ú÷ģļůÉ…āÄŇŗūB(y®£ng)«įňńŐžĶńľöįŻĪ∂‘ŲňŔ∂»ĺý « 0.57 d-1£¨∂Ý∑N◊”ŇŗūB(y®£ng)«įňńŐžĶńľöįŻĪ∂‘ŲňŔ∂» « 0.54 d-1°£
ąD 6 Ô@ ĺĶń ««ÚřD(zhu®£n)«Ú?q®Ī)ćÚ?B2B #4 «įļů Vero ľöįŻ‘ŕőĘ›důw…ŌĶń…ķťL«ťõr°£Ņ…“‘ŅīĶĹ«ÚřD(zhu®£n)«Ú÷ģļůĶńŇŗūB(y®£ng)Žm»Ľ∆ū ľľöįŻĒĶ(sh®ī)›^…Ŕ£¨ĶęľöįŻŔNĪŕļÕīśĽÓ«ťõr»‘»Ľ≤ĽŚe°£‘ŕ∆šļůĶńé◊Őž÷–ľöįŻ…ķťLĶń–őĎB(t®§i)“≤ļ‹∑Ä(w®ßn)∂®ļÕŃľļ√°£Žm»Ľ‘ŕ◊Ó≥űé◊ŐžŅīň∆ľöįŻ‘ŕőĘ›důw…Ō∑÷≤ľ≤ĽĺýĄÚ£¨ĶęľöįŻ‘Ų÷≥’ż≥£≤Ę‘ŕ∆šļůé◊Őž—łňŔ≤ľĚMňý”–ĶńőĘ›důw°£

ąD6.«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěB2B #4«įļů VeroľöįŻ‘ŕőĘ›důw…ŌĶń…ķťL«ťõr
B2B #5 ≤…”√Ķŕ∂Ģ∑N∑Ĺ ĹŖM––łŖĪ∂¬ ∑Ňīů°£”√ 3g/L ĶńőĘ›důw√‹∂»ŇŗūB(y®£ng) Vero ľöįŻ÷ŃľöįŻ√‹∂» 3.07x106/ļŃ…ż,ŇŗūB(y®£ng)ůw∑eěť 3 …ż°£”√“»√łį— Vero ľöįŻŹńőĘ›důw…ŌŌŻĽĮŌ¬ĀŪ°£»° ģ∑÷÷ģ“ĽĶńľöįŻ/őĘ›důwĎ“ł°“ļĹ”∑NĶĹ–¬Ķń 1.5 …żĶńŇŗūB(y®£ng)ůw∑e÷–£¨őĘ›důwĚ‚∂»ěť 6g/L°£īżľöįŻ√‹∂»Ŗ_ĶĹ 5x106/ļŃ…ż“‘…Ōēr£¨—a≥š–¬űrŇŗūB(y®£ng)Ľý÷ŃŇŗūB(y®£ng)ůw∑e 3…ż°£Ŗ@ė”ŇŗūB(y®£ng)ůw∑eľįőĘ›důwĪŪ√ś∑eĶń∑ŇīůĪ∂ĒĶ(sh®ī)ĺý « ģĪ∂£¨◊ÓĹKőĘ›důwĚ‚∂»ěť3g/L°£∂Ý‘ŕŇŗūB(y®£ng)≥ű∆ŕ£¨ľöįŻ√‹∂»ļÕőĘ›důw√‹∂»ĺýĶ√ĶĹŐŠłŖ£¨Źń∂ÝŐŠłŖŃňőĘ›důwļÕľöįŻĶńĹ””|ôC¬ £¨ņŪ’ď…Ō”–ņŻ”ŕľöįŻŔNłĹĶĹőĘ›důw…Ō≤Ęń‹łŁļ√Ķō…ķťL°£◊ųěť∆Ĺ––Ī»›^‘áÚě£¨»° ģ∑÷÷ģ“ĽĶńľöįŻ/őĘ›důwĎ“ł°“ļĹ”∑NĶĹŃŪ“ĽāÄľöįŻŇŗūB(y®£ng)īŁ÷–£¨ŇŗūB(y®£ng)ůw∑e 3…ż£¨őĘ›důwĚ‚∂» 3g/L°£É…āÄŇŗūB(y®£ng)Õ¨ērŖM––£¨”^≤žľöįŻ…ķťLĶń«ťõr°£
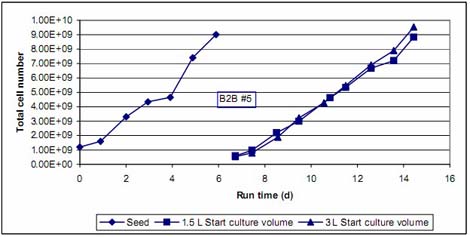
ąD 7.«ÚřD(zhu®£n)«Ú?q®Ī)ćÚ?B2B #5«įļůľöįŻ…ķťL«ķĺÄ
ąD 7 Ô@ ĺĶń «…Ō Ų«ÚřD(zhu®£n)«Ú?q®Ī)ćÚ?B2B #5 «įļůĶńľöįŻ…ķťL«ķĺÄ°£”…”ŕ∆š÷–“ĽāÄ‘ŕŇŗūB(y®£ng)Ŗ^≥Ő÷–”–ŇŗūB(y®£ng)ůw∑eĶń◊ÉĽĮ£¨Ŗ@ņÔĶńŅv◊Ýėň≤…”√ľöįŻŅāĒĶ(sh®ī)°£«ÚřD(zhu®£n)«Ú«įļůľöįŻ…ķťLňŔ∂»ĽýĪĺ“Ľ÷¬°£«ÚřD(zhu®£n)«Ú“‘ļůľöįŻ»‘»ĽĪ£≥÷Õķ ĘĶń…ķťLĽÓѶ°£Õ¨ė””–“‚ňľĶń «£¨«ÚřD(zhu®£n)«Úļů≤…”√›^–°ĶńŇŗūB(y®£ng)ůw∑eŇŗūB(y®£ng)£¨Źń∂Ý ĻÜőőĽůw∑eÉ»(n®®i)ľöįŻ√‹∂»ļÕőĘ›důw√‹∂»ŐŠłŖ£¨ľöįŻļÕőĘ›důwĹ””|ôC¬ ŐŠłŖ£¨Ŗ@ė”Ķń∑Ĺ∑®≤Ęõ]”–Ô@÷ÝĶōŐŠłŖľöįŻĶń…ķťLňŔ¬ °£Ŗ@ĪŪ√ųľöįŻ‘ŕ…‘ĶÕĶńĹ”∑N√‹∂»Ō¬“≤ń‹ļ‹ļ√Ķń…ķťL∆ūĀŪ£¨≤Ę≤Ľ–Ť“™”√ĹĶĶÕ∆ū ľŇŗūB(y®£ng)ůw∑eĶń∑Ĺ∑®ĀŪŐŠłŖĹ”∑N√‹∂»°£
ąD8.«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěB2B #5«įļů VeroľöįŻ‘ŕőĘ›důw…ŌĶń…ķťL«ťõr
ąD 8 Ô@ ĺĶń «…Ō Ų«ÚřD(zhu®£n)«Ú?q®Ī)ćÚ?B2B #5 «įļů Vero ľöįŻ‘ŕőĘ›důw…ŌĶń…ķťL«ťõr°£“Ú«ÚřD(zhu®£n)«Ú÷ģļůŇŗūB(y®£ng)÷–ľöįŻ∆ū ľ√‹∂»›^ĶÕ£¨ŇŗūB(y®£ng)ērťg—”ťLŃňÉ…Őž°£“≤“Úīň£¨≥żŃňŌŗĎ™(y®©ng)”ŕ∑N◊”ŇŗūB(y®£ng)Ķń‘ŕĶŕ“Ľ°Ę»ż°ĘŃýŐžĶńľöįŻ–őĎB(t®§i)Õ‚£¨ő“āÉŖ@ņÔ“≤Ń–≥ŲŃň«ÚřD(zhu®£n)«ÚļůŇŗūB(y®£ng)ŃňĺŇŐžļůľöįŻ‘ŕőĘ›důw…ŌĶń–őĎB(t®§i)’’∆¨°£«ÚřD(zhu®£n)«ÚļůľöįŻŔNłĹļÕ…ķťL«ťõrŃľļ√°£ő“āÉ“≤ŅīĶĹ∑÷Ąe”√ 1.5 L ļÕ 3 L Ķń∆ū ľ√‹∂»ŇŗūB(y®£ng)ľöįŻ◊Ó≥űĶńŔNłĹ«ťõr£¨ŔNłĹĒĶ(sh®ī)ŃŅ£¨“‘ľįļů√śĶńľöįŻ…ķťL«ťõrĽýĪĺõ]”–≤Óģź°£Ŗ@“≤ŐŠ ĺŃňŐŠłŖÜőőĽůw∑eÉ»(n®®i)ľöįŻ√‹∂»ļÕőĘ›důw√‹∂»£¨Źń∂ÝŐŠłŖľöįŻļÕőĘ›důwĹ””|ôC¬ Ķń∑Ĺ∑®≤Ęõ]”–éßĀŪŐęīůĶńļ√Őé°£
”Ď’ď
‘ŕŖ@“Ľ≤Ņ∑÷ĶńĻ§◊ų÷–£¨ő“āÉ◊ŲŃň Vero ľöįŻŹńőĘ›důw…ŌĶń«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě£¨ľöįŻŇŗūB(y®£ng)‘ŕ WAVETM ∑īĎ™(y®©ng)∆ųÉ»(n®®i)ŖM––£¨«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě‘ŕ∆Ņ◊”É?n®®i)ĽÚ WAVETM ŇŗūB(y®£ng)īŁÉ»(n®®i)ŖM––°£ĆćÚěĹY(ji®¶)ĻŻÔ@ ĺ«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěŌŗģĒ≥…Ļ¶£¨Vero ľöįŻĶńőĘ›důwŇŗūB(y®£ng)‘ŕ WAVETM ∑īĎ™(y®©ng)∆ųÉ»(n®®i)∑Ňīů «Ņ…––Ķń°£
ő“āÉ∑÷ĄeáL‘áŃň‘ŕ∆Ņ◊”÷–£®B2B #1£©ļÕ‘ŕ WAVETM ŇŗūB(y®£ng)īŁ÷–£®B2B #2 ļÕ B2B #3)ŖM––«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě°£‘ŕĆćÚě “–°“?gu®©)ń£«ťõrŌ¬£¨‘ŕ∆Ņ◊”÷–ŖM––«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěŌŗĪ»‘ŕľöįŻŇŗūB(y®£ng)īŁ÷–ŖM––”–“Ľ∂®ĶńÉě(y®≠u)Ą›°£«į’Ŗ≤Ŕ◊ų∆ūĀŪĪ»›^»›“◊°£‘ŕ“ĽāÄÕł√ųĶń∆Ņ◊”÷–£¨≥ŃĹĶļůĶńőĘ›důwłŁ»›“◊ĪĽ«ŚőķĶōŅīĶĹ£¨ňý“‘ń‹łŁ∂ŗĶō»•≥ż…Ō«Ś°£Ŗ@ė”őĘ›důwń‹Ķ√ĶĹłŁ”––ßĶń«ŚŌī°£ŃŪÕ‚∆Ņ◊”“≤Ņ…“‘”√ňģ‘°ĀŪĪ£≥÷ļ„úō£¨»ÁĻŻ≤ĽŐęīůĶń‘íŅ…“‘›^Ą°Ń“ĶōďuĄ”°£Ŗ@ė”ľöįŻń‹łŁ”––ßĶō√ďŽxőĘ›důw°£»Ľ∂Ý£¨»ÁĻŻŅľĎ]ĶĹīů“é(gu®©)ń£ĶńŇŗūB(y®£ng)£¨«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě–Ť“™‘?WAVETM ŇŗūB(y®£ng)īŁÉ»(n®®i)ŖM––£¨“ÚěťŖ@ė”ĺÕ”–“ĽāÄ»ę∑‚ť]ĶńŌĶĹy(t®Įng)ĀŪłŁļ√Ķō≤Ŕ◊ų›^īůĶńůw∑e°£ŹńWAVETM ŇŗūB(y®£ng)īŁ÷–ŖM––«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě£®B2B #2ļÕB2B #3) Ķ√ĶĹĶńĹY(ji®¶)ĻŻĀŪŅī£¨Ŗ@∑N∑Ĺ∑®–ßĻŻ“≤ļ‹≤ĽŚe£¨÷Ľ «–Ť“™›^∂ŗĶń PBSĀŪŌīúž£¨“»√łĶń”√ŃŅ“≤…‘∂ŗ°£
“»√łŌŻĽĮ›^ťLērťgń‹ČÚłŁļ√Ķō ĻľöįŻļÕőĘ›důwÕÍ»ę∑÷Žx°£ĶęŌŻĽĮŐęťLērťg“≤ēĢĹĶĶÕľöįŻĽÓѶ≤Ę”įŪĎľöįŻ÷ō–¬ŔNĪŕĶń–ßĻŻ°£“Úīň“»√łŌŻĽĮĶńērťg◊Óļ√ń‹Ņō÷∆‘ŕ40 ∑÷Áä÷ģÉ»(n®®i)°£ŌŻĽĮŖ^≥Ő÷–£¨≥żŌŻĽĮērťgÕ‚£¨√ł”√ŃŅ°Ę∑īĎ™(y®©ng)úō∂»°ĘőĘ›důwļÕ√ł÷ģťg≥š∑÷ĶńĽžļŌ «Ī£◊C≤ĽÕ¨őĘ›důw…ŌľöįŻÕ¨≤ĹŌŻĽĮĶń÷ō“™“Úňō£¨Źń∂Ý”––ßĪ‹√‚√łĶńĺ÷≤ŅŖ^ŃŅļÕĚď‘ŕĶńľöįŻďpāŻ°£
ŌŗĪ»ĒáįŤĻř∂Ý—‘£¨WAVE ∑īĎ™(y®©ng)∆ų‘ŕÕ¨“ĽāÄŇŗūB(y®£ng)īŁ÷–Ņ…“‘”–łŁĆíĶńŇŗūB(y®£ng)∑∂áķ£®10-100%Ļ§◊ųůw∑e£©£¨Ć¶”ŕ∑N◊”ĒU‘ŲļÕľöįŻŌŻĽĮĶń≤ĽÕ¨∑īĎ™(y®©ng)ůw∑e£¨∂ľŅ…“‘ŐŠĻ©ĺýĄÚ”––ßĶńĽžļŌ£¨Źń∂ÝĆć¨F(xi®§n)őĘ›důwĶń‘≠őĽŌŻĽĮ£¨∂Ýüo–ŤŐō∂®ĶńŌŻĽĮ∑īĎ™(y®©ng)∆ų°£Ī‹√‚ŃňŌŻĽĮ«įļůőĘ›důwĶńřD(zhu®£n)“∆£¨≤Ŕ◊ųļÜÜő£¨ĺýĄÚ”––ßĶńĽžļŌ”–ņŻ”ŕĺę√‹Ņō÷∆ŌŻĽĮ∑īĎ™(y®©ng)ĶńólľĢ£¨◊Óīů≥Ő∂»Ī£◊CľöįŻĶńÕÍ’Ż–‘ļÕĽō ’£¨≥…ěťőĘ›důw«ÚřD(zhu®£n)«Ú≥…Ļ¶∑ŇīůĶńÍP(gu®°n)śI°£
«ÚřD(zhu®£n)«Ú?q®Ī)ćÚ?B2B #4 ļÕ#5 ĶńĹY(ji®¶)ĻŻŐŠ ĺ£¨«ÚřD(zhu®£n)«ÚŖM––łŖĪ∂¬ ∑Ňīů“≤ÕÍ»ęŅ…––£¨∑ŇīůĪ∂¬ Ņ…“‘Ŗ_ĶĹ ģĪ∂£¨«įŐŠĎ™(y®©ng)‘ď «◊Ć∑N◊”ŇŗūB(y®£ng)Ŗ_ĶĹ◊„ČÚĶńľöįŻ√‹∂»“‘Ī£◊Cń‹”–◊„ČÚ∂ŗĶńľöįŻŖM»ŽŌ¬“Ľ≤ĹŇŗūB(y®£ng)°£◊„ČÚĶńľöįŻĹ”∑N√‹∂»£¨“‘ľįľöįŻĒĶ(sh®ī)ļÕőĘ›důwĪŪ√ś∑eĶńĪ»ņżÉ…’ŖĻ≤Õ¨Ī£◊CŃňľöįŻĶń”––ßŔNĪŕ≤ĘŅžňŔŖM»Ž…ķťL∆ŕ°£∂Ýő“āÉĶńĆćÚěĪŪ√ų£¨«ÚřD(zhu®£n)«ÚļůőĘ›důwĪŪ√ś∑eĽÚ’Ŗ «ŇŗūB(y®£ng)ůw∑eĶń‘ŕ–°∑∂áķÉ»(n®®i)Ķń◊ÉĽĮĺý≤ĽēĢƶľöįŻĶńŔNĪŕļÕ…ķťLģa(ch®£n)…ķŐęīůĶń”įŪĎ°£
ő“āÉ‘ŕŖ@ņÔňý√Ť ŲĶńé◊īő«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěĺý «į—“Ľ≤Ņ∑÷ŇfĶńőĘ›důwÕ¨ľöįŻ“Ľ∆ūřD(zhu®£n)“∆ĀŪÕÍ≥…Ķń°£Źńłųīő«ÚřD(zhu®£n)«Ú?q®Ī)ćÚě«įļůľöįŻ‘ŕőĘ›důw…Ō…ķťLĶń–őĎB(t®§i)ĀŪŅī£¨ľöįŻń‹‘ŕőĘ›důw…ŌĺýĄÚĶō∑÷≤ľ°£“Úīň£¨ŇfĶńőĘ›důwÕ¨ľöįŻ“Ľ∆ūřD(zhu®£n)“∆≤Ę≤Ľ”įŪĎľöįŻŔNĪŕĶĹ–¬ĶńőĘ›důw…Ō°£»ÁĻŻ≤ĽļÕŇfĶńőĘ›důw“Ľ∆ūřD(zhu®£n)“∆Ķń‘í£¨ĺÕ–Ť“™į—ľöįŻļÕőĘ›důw∑÷Žx°£Ŗ@ĺÕ“‚
ő∂÷Ý–Ť“™Ó~Õ‚Ķń≤ĹůEļÕ›^ťLĶńĻ§ňáērťg°£Ŗ@–©Ó~Õ‚Ķń≤ĹůEŖÄ–Ť“™łŁ∂ŗŹÕ(f®ī)ŽsĶń‘O(sh®®)āš“Ú∂Ý“≤‘ŲīůŃňőŘ»ĺĶńÔLŽU°£”…”ŕľöįŻõ]”–‘ŕőĘ›důw…Ō≤ĽĺýĄÚĶń∑÷≤ľĽÚłŁľĮ÷–”ŕŇfőĘ›důwĶń«ťõr£¨ő“āÉ’Jěťõ]”–Īō“™į—ľöįŻļÕŇfĶńőĘ›důw∑÷ť_°£
ĹY(ji®¶)’ď
Õ®Ŗ^‘ŕ∆Ņ◊”ņÔĽÚ÷ĪĹ”‘ŕľöįŻŇŗūB(y®£ng)īŁ÷–ŖM––ĶńľöįŻļÕőĘ›důw∑÷ŽxĶń∑Ĺ∑®£¨WAVETM ∑īĎ™(y®©ng)∆ų÷–Ķń«ÚřD(zhu®£n)«Ú?q®Ī)ćÚěń(z®°i)‹ČÚ≥…Ļ¶ĶōŖM––°£«“∑ŇīůĪ∂¬ Ņ…“‘ļ‹»›“◊ĶōŖ_ĶĹ ģĪ∂°£řD(zhu®£n)“∆÷ģļů Vero ľöįŻń‹Ī£≥÷ļÕ∑N◊”ľöįŻŌŗň∆Ķń…ķťLŐō’ų°£…ķťL‘ŕőĘ›důw…ŌĶńVero ľöįŻ”√ 37°śÓA(y®ī)üŠĶń PBS-EDTA Ōīúž£¨”√ 37°śÓA(y®ī)üŠĶń“»√łŖM––ŐéņŪ£¨“»√łŐéņŪĶńērťg≤Ľ≥¨Ŗ^40∑÷Áä°£řD(zhu®£n)“∆Ŗ^≥Ő÷–õ]”–Īō“™į—ľöįŻļÕŇfĶńőĘ›důw∑÷ť_°£
WAVE őĘ›důw«ÚřD(zhu®£n)«Úľľ–g(sh®ī)ěťőĘ›důwľöįŻŇŗūB(y®£ng)Ķń“é(gu®©)ń£∑ŇīůŐŠĻ©ŃňŅ…ŅŅ÷ß≥÷£¨‘ďľľ–g(sh®ī)Ņ…“‘‘ŕÕ¨“ĽāÄŇŗūB(y®£ng)īŁ÷–Ćć¨F(xi®§n)‘≠őĽŌŻĽĮ£¨»Ľļů÷ĪĹ”řD(zhu®£n)“∆ĶĹłŁīů“é(gu®©)ń£Ķń WAVE ∑īĎ™(y®©ng)∆ų÷–÷ō–¬ŔNĪŕĒU‘Ų∂ÝüoŪö Ļ”√Üő™öĶńŌŻĽĮ∑īĎ™(y®©ng)∆ų£¨ŌŻĽĮólľĢ»›“◊Ņō÷∆£¨‘O(sh®®)āšÕ∂ŔY≥…ĪĺĶÕ£ĽüoĺķļłĹ”ôCļÕ∑‚ŅŕôCŇšļŌľöįŻŇŗūB(y®£ng)īŁŅ…“‘∑ĹĪ„ĶńĆć¨F(xi®§n)üoĺķĻ‹ĶņĽĮ∑‚ť]…ķģa(ch®£n)£¨≤ĽÉH≤Ŕ◊ųļÜÜőĪ‹√‚őŘ»ĺ£¨Õ¨ēr∑ņ÷Ļ≤Ŕ◊ų»ňÜTƶ≤°∂ĺĶńĪ©¬∂£¨Ćć¨F(xi®§n)łŁľ”į≤»ęĶń…ķģa(ch®£n)≤Ŕ◊ų°£“Úīň£¨WAVE …ķőÔ∑īĎ™(y®©ng)∆ųŖM––“é(gu®©)ń£ĽĮőĘ›důwľöįŻŇŗūB(y®£ng)Ņ…“‘»°īķ∑Ī»ŖĶńřD(zhu®£n)∆ŅļÕ∂ŗāÄ–°“é(gu®©)ń£∑īĎ™(y®©ng)∆ųĶńŇŗūB(y®£ng)Ļ§ňᣨ≥…ěť“Ŗ√Á“é(gu®©)ń£ĽĮīů…ķģa(ch®£n)Ķńįl(f®°)’ĻŕÖĄ›°£
ÖĘŅľőń’¬
[1]. History and Characterization of the Vero Cell Line -- A Report prepared by CDR Rebecca Sheets, Ph.D., USPHS CBER/OVRR/DVRPA/VVB for the Vaccines and Related Biological Products Advisory Committee Meeting to be held on May 12, 2000 OPEN SESSION www.fda.gov pdf
[2]. Cell culture (Vero) derived whole virus (H5N1) vaccine based on wild-type virus strain induces cross-protective immune responses. Kistner O, Howard MK, Spruth M, Wodal W, Bruohl P, Gerencer M, Crowe BA, Savidis-Dacho H, Livey I, Reiter M and others. 2007, Vaccine 25(32):6028-6036.
[3]. Flu Vaccine Race Against The Clock. Thayer AM. 2009, Chemical & Engineering News, September 28, 2009, 87(39), p27-33
[4]. A novel mammalian cell (Vero) derived influenza virus vaccine: Development, characterization and industrial scale production. Kistner O, Barrett PN, Mundt W, Reiter M, Schober-Bendixen S, Eder G, Dorner F. 1999. Wiener Klinische Wochenschrift 111(5):207-214.
[5]. High immunogenic enterovirus 71 strain and its production using serum-free microcarrier Vero cell culture. Liu CC, Lian WC, Butler M, Wu SC. 2007. Vaccine 25(1):19-24.
- “Ľīő–‘∑īĎ™(y®©ng)∆ų‘ŕĽý”ŕőĘ›důwŇŗūB(y®£ng)Ķń≤°∂ĺ–‘“Ŗ√Á÷–ĶńĎ™(y®©ng)”√
- īůńcóUĺķ‘ŕ≤ĽÕ¨ůw∑e“Ľīő–‘…ķőÔ∑īĎ™(y®©ng)∆ų…ŌĶńłŖ√‹∂»ŇŗūB(y®£ng)—–ĺŅ
- °į»ňĻ§÷«ń‹Ķń—›ŖMľį∆š‘ŕ…ķőÔĻ§ňá÷–ĶńĎ™(y®©ng)”√°ĪÜĖīūļŌľĮ
- Ļ§ňáť_įl(f®°)ŇcÉě(y®≠u)ĽĮ£ļ…Ō”őľöįŻŇŗūB(y®£ng)ĶńĆćŘ`Ňc≤Ŗ¬‘
- őĘ›důwŌŗÍP(gu®°n)Ļ§ňáĶńŐōŁc
- B–ÕŃųł–“Ŗ√Á÷Í…ķőÔ∑īĎ™(y®©ng)∆ųŇŗūB(y®£ng)Ļ§ňáÉě(y®≠u)ĽĮ
- …ķőÔľľ–g(sh®ī)÷–įl(f®°)ĹÕĻřŇc…ķőÔ∑īĎ™(y®©ng)∆ųĶńįl(f®°)’ĻŇcĎ™(y®©ng)”√
- Ļ”√áÝģa(ch®£n)…ķőÔ∑īĎ™(y®©ng)∆ųērĶń◊Ę“‚ ¬Ūó
- į¨ōźŐ©—ŻńķÖĘľ”…ķőÔ÷∆ňéĻ§ňáĎ™(y®©ng)”√ŇcĄď(chu®§ng)–¬—–”ĎēĢ
- į¨ōźŐ©’\—ŻńķÖĘľ”2024BIOCHINA»AńŌ…ķőÔģa(ch®£n)ėI(y®®)īůēĢ
- ĶŌĪō†Ė…ķőÔ∑īĎ™(y®©ng)∆ųę@‘u"2024…ķőÔ÷∆‘žģa(ch®£n)ėI(y®®)ĽĮÉě(y®≠u)–„įłņż"
- į¨ōźŐ©ŇcŅĶĆéŖ_≥…Ďū(zh®§n)¬‘ļŌ◊ų°™ĺę’\ļŌ◊ų£¨Ľ•÷ķĻ≤ŕA
- į¨ōźŐ©ŃŃŌŗ2024BPDĶŕ∆ŖĆ√…ķőÔňéĻ§ňáįl(f®°)’ĻīůēĢ
- į¨ōźŐ©—ŻńķÖĘľ”2024BPDĶŕ∆ŖĆ√…ķőÔňéĻ§ňáįl(f®°)’ĻīůēĢ
- į¨ōźŐ©’\—ŻńķÖĘľ”Ķ໿Ć√BIONNOVAőų≤ŅĄď(chu®§ng)–¬’ďČĮ
- į¨ōźŐ©°ĘInnoCellularŇcEVANTICAĒy ÷ļŌ◊ųÕ‚√ŕůw—–ĺŅ
Copyright(C) 1998-2024 …ķőÔ∆ų≤ńĺW(w®£ng) Žä‘í£ļ021-64166852;13621656896 E-mail£ļinfo@bio-equip.com