Ū(dĻĄng)Į°ÎŧÖà > ĘŨí > žžÐg(shĻī)ÎÄÕ > ž°ûīĐÄĪëÄũßfCĀíž°ŅÐūŋĮ°ū°
ž°ûīĐÄĪëÄũßfCĀíž°ŅÐūŋĮ°ū°
ž°ûīĐÄĪëÄũßfCĀíž°ŅÐūŋĮ°ū°
ĩÂŋËË_ËđA&MīóW(xuĻĶ)ĢĻTAMUĢĐJean-Phillipe PelloisēĐĘŋŅÐūŋ―MĩÄÅdČĪÔÚÓÚĀí―âķāëÄČįšÎČÜ―âŧōÕßŋįß^ÉúÎïÄĪĢŽŌÔž°ß\ÓÃß@·―ÃæĩÄÖŠŨRé_°l(fĻĄ)ÄÜōĘđĩ°°ŨBÍļž°ûĩÄÔĐĄĢÄÜōĘđĩ°°ŨBÍļĩ―ž°ûÔÚát(yĻĐ)W(xuĻĶ)ŧōÕßž°ûÉúÎïW(xuĻĶ)ÉÏÓКÜīóÔÚÓÃÍūĢŽß@ÓŨöŨîÓÐÎüŌýÁĶĩÄ·―·Ļ°üĀĻ°Ņĩ°°ŨÎüļ―ĩ―îËÆÓÚž°ûīĐÄĪëÄĢĻCPPĢĐß@ÓĩÄÝdówÏĩ―y(tĻŊng)ÉÏĄĢCPPsĘĮŌŧ·Ny§īó·ÖŨÓÝdówß\Ý?shĻī)―ž°û?nĻĻi)ĩÄķāëÄĢŽÆäÔÐÍĀýŨÓ°üĀĻŌŧ·NíÔīÓÚHIVĩÄķāëÄTAT(GRKKRRQRRR)ĄĢCPP-ĩ°°ŨÅžšÏÎï·ÖÉē―īĐČëž°ûĄĢĘŨÏČĢŽCPP-ĩ°°ŨÅžšÏÎïÍĻß^°ûĘÉŨũÓÃßMČëž°ûĢŽß@ÐĐ·ÖŨÓÎŧÓÚž°ûČ(nĻĻi)ĢŽĩŦĘĮąŧēķŦ@ÔÚČ(nĻĻi)šówČ(nĻĻi) (Fig 1A)ĄĢČŧšóß@ÐĐ·ÖŨÓÄČ(nĻĻi)šówá·ÅģöíĢŽCPP-ĩ°°ŨÅžšÏÎïĖÓëxČ(nĻĻi)šówēĒßMČëž°ûĩÄ°ûŲ|(zhĻŽ)ŋÕégĄĢ
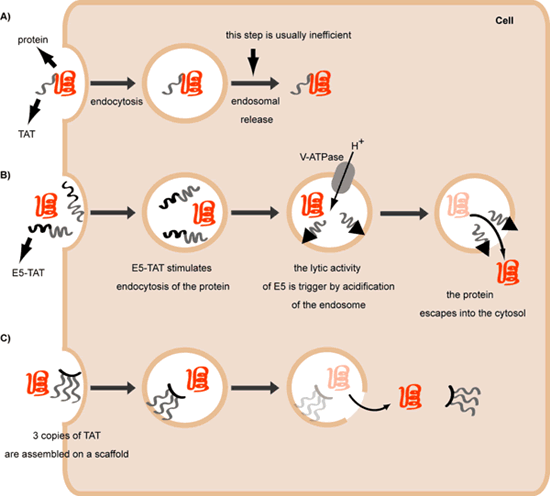
D 1 ÍĻß^īŲßMČ(nĻĻi)šówČÜ―âũßfīó·ÖŨÓĄĢA)ÄŋĮ°ũßfđĪūßĢŽĀýČįîËÆÓÚTATĩÄCPPsĢŽēŧÄÜĘđīó·ÖŨÓÄČ(nĻĻi)šówá·ÅģöíĄĢB)Č(nĻĻi)šówČÜ―âëÄE5-TATīŲßMČ(nĻĻi)šówĩÄá·ÅĢŽŋÉÍĻß^šÎĩÄđē·õÓýēŲŨũē―óEÓÃÓÚũßfīó·ÖŨÓĄĢCĢĐķār―Y(jiĻĶ)(gĻ°u)ČįČýūÛówTAT3ÍŽÓŋÉĘđČ(nĻĻi)šówá·Åíũßfīó·ÖŨÓĄĢ
ęP(guĻĄn)ÓÚČ(nĻĻi)šówá·Åĩ°°ŨĩÄCÖÆÁË―âēŧķāĄĢķøĮŌĢŽÔß^ģĖЧÂĘ·ĮģĢĩÍĄĢß@īúąíÁËŌŧÖũŌŠÆŋîiĢŽŌōéĩ°°ŨÎīÄČ(nĻĻi)šówģÉđĶĖÓëxĒēŧŪa(chĻĢn)ÉúÉúÎï·īŠ(yĻĐng)ĄĢéÁËĖáļßЧÂĘēĒĮŌĘđĩ°°ŨÄÜČÝŌŨĩØũßfĩ―ž°ûĢŽPelloisōĘŌÕýŅÐūŋŨīŲßMČ(nĻĻi)šówá·ÅēßÂÔĄĢî}ĘĮŌŠĘđČ(nĻĻi)šówĩÄÄĪČÜ―âķøēŧŌýÆðÆäËüž°ûĩÄÄĪÆÆÁŅĢŽŌōéß@Óþ§(dĻĢo)Öž°ûËĀÍöĄĢ
ÍĻß^pHĒÓĩÄČ(nĻĻi)šówČÜ―âíũßf
Ōŧ·NČÜ―âČ(nĻĻi)šówķøēŧČÜ―âÆäËüÄĪĩÄ·―·Ļ°üĀĻēÉÓÃŌĀŲpHÖĩĩÄūßÓÐČÜ―âŨũÓÃĩÄķāëÄĄĢß@ĘĮŧųÓÚČ(nĻĻi)šówĮŧéËáÐÔ(pH 4.5-6.5)ĢŽß@ĖáđĐÁËž°ûČ(nĻĻi)ĖØĘâĩÄŧŊW(xuĻĶ)h(huĻĒn)ūģĄĢĀýČįĢŽķāëÄE5(GLFEAIAEFIENGWEGLIEGWYG)ĘĮÁũļÐHA2ČÚšÏëÄĩÄîËÆÎïĢŽÔŅÐūŋ―Mŋž]E5ÄÜ·ņŨũéČÚšÏÎïīŲßMÖØ―Mĩ°°ŨĩÄũßfĄĢËûzyĩ―ÔÚËáÐÔpHÏÂE5Ų|(zhĻŽ)ŨÓŧŊēĒ―Y(jiĻĶ)šÏĩ―ÖŽŲ|(zhĻŽ)ëpÓĄĢČŧšóĢŽÐÎģÉŋŨ―Y(jiĻĶ)šÏĖŨãōīóŋÉŨīóĩ°°ŨÍĻß^ÄĪUÉĒ[Ref 1]ĄĢéÁËŅÐūŋß@ÐĐķāëÄÔÚž°ûČ(nĻĻi)ĩÄŧîÓĢŽÔŅÐūŋ―MēÉÓÃÉđâĩ°°ŨE5-TAT-mCherryŨũéÄĢÐÍĢŽÔÚÔÏĩ―y(tĻŊng)ÖÐĢŽE5ÓÃÓÚČÜ―âČ(nĻĻi)šówĢŽTATÓÃÓÚĩ°°ŨČ(nĻĻi)ĘÉŨũÓÃĢŽmCherryĖáđĐÉđâÐÅĖĢŽŌÔąãÔÚÉđâï@ÎĒįRÏÂÓ^yĄĢ
PelloisŅÐūŋ―M°l(fĻĄ)ŽF(xiĻĪn)ĢŽŪ(dĻĄng)E5-TAT-mCherryÍŽŧîž°û·õÓýrĢŽËüÄÜōČÜ―âČ(nĻĻi)šówĢŽĩŦĘĮžīĘđÔÚČÜ―â°l(fĻĄ)ÉúšóĢŽE5ĘđE5-TAT-mCherryČÔČŧÅcČ(nĻĻi)šówÏāÂ(liĻĒn)ĄĢŌŧ·NŋÉÄÜĩÄ―âáĘĮĢŽE5ČÔČŧēŧŋÉÄæĩØ―Y(jiĻĶ)šÏĩ―Č(nĻĻi)šówÄĪÉÏĢŽëmČŧE5§(dĻĢo)ÖÂÁËČ(nĻĻi)šówČÜ―âĢŽĩŦŨčÖđÁËĩ°°Ũá·ÅĄĢĘÜß@ÐĐ―Y(jiĻĶ)đûđÄÎčĢŽ PelloisŅÐūŋ―Mßï@ĘūÄÜōÍĻß^ÅcE5-TATũßfīó·ÖŨÓĢŽß@ßmÓÃÓÚ―MŋÅāðB(yĻĢng)zy(Fig 1B) [Ref 2]ĄĢE5-TATÄÜōĘđž°ûÎüČëÆäÖÜúšŽīó·ÖŨÓĩÄÅāðB(yĻĢng)ŧųĄĢŌōīËĢŽE5-TATšÍđē·õÓýĩÄīó·ÖŨÓÄÜōđēÍŽūÛžŊĩ―Č(nĻĻi)šówĄĢŌŧĩĐČ(nĻĻi)šówËáŧŊĢŽE5-TAT§(dĻĢo)ÖÂÁËČ(nĻĻi)šówČÜ―âĢŽÎŧÓÚČ(nĻĻi)šówĮŧĩÄīó·ÖŨÓŨÔÓÉĖÓŌÝĩ―ž°ûŲ|(zhĻŽ)ŋÕégēĒ°l(fĻĄ)]ÆäÉúÎïđĶÄÜĄĢ
ēÉÓÃūßÓзÖÖ§ĩÄCPPsĩÄũßf
ŌŠļÄßMCPPsČ(nĻĻi)šówČÜ―âŧîÐÔĩÄÏë·ĻĘĮ(chuĻĪng)ÐÂķārÏĩ―y(tĻŊng)íÔöžÓÔÚČ(nĻĻi)šówÄĪÉÏūÖēŋâķČĄĢPelloisŅÐūŋ―MĖ―ËũÁËÍĻß^šÏģÉķāTATŋ―Ø(TATn, n = 2, 3, 4, 5 ,6 ) ĩÄ·ÖÖ§ î·ÖŨÓĩÄ·―·Ļ[Ref 3]ĄĢîËÆÓÚTATĢŽTAT2ßMČëČ(nĻĻi)šówĢŽēŧÄÜČÜ―âČ(nĻĻi)šówĄĢTAT4ĄĒTAT5ĄĒTAT6ķžēŧÄÜļÄßMīó·ÖŨÓũßfĢŽŌōéß@ÐĐŧŊšÏÎï―Y(jiĻĶ)šÏĩ―ž°ûŲ|(zhĻŽ)ÄĪÉÏēŧŧîÜSĄĢÏāąČÖŪÏÂĢŽTAT3ĘĮŠĖØĩÄĢŽŌōéĢŽÔ(gĻ°u)ÔėÄÜōČÜ―âČ(nĻĻi)šówēĒąČÆäËüķāūÛówîËÆÎïļüÓÐЧĩØ°Ņīó·ÖŨÓũßfĩ―ž°ûŲ|(zhĻŽ)ÄĪ(Fig 1C)ĄĢÄŋĮ°ĢŽËûÕýŅÐūŋTAT3ÔÚ·ÖŨÓËŪÆ―ÉÏÄÜ·ņĘđČ(nĻĻi)šówÄĪČÜ―âŌÔž°TATŨÔÉíČįšÎÐÐĘđÆäŨÔÉíđĶÄÜĩÄĄĢ
ÓÃéWđâĒÓČ(nĻĻi)šówČÜ―âĩÄũßf
ÓÃČÜ―âČ(nĻĻi)šówĩÄĩÚČýÓÐÎüŌýÁĶĩÄ·―·ĻÓÃŋÉŌđâžĪ°l(fĻĄ)Č(nĻĻi)šówĀïīæÔÚĩÄTATÉđâÍ(fĻī)šÏÎïĄĢPelloisŅÐūŋ―MŨCÃũÓÃTMRĢĻtetramethylrhodamineĢŽËÄžŨŧųÁ_ĩĪÃũĢĐË(biĻĄo)ÓTATĩÄTMR-TATÔÚÕÕÉäšóŨÃëČ(nĻĻi)ÄÜōČÜ―âČ(nĻĻi)šów(Fig 2)ĄĢÔŨũÓÃĘĮļųþ(jĻī)ŌŧĩĐžĪ°l(fĻĄ)TMRĢŽÄĪÉÏūÍŪa(chĻĢn)ÉúŧîÐÔÎÓÎëxÖØB(tĻĪi)Ņõ·ÖŨÓ[Ref 4]ĄĢËûĩÄÄĢÐÍĘĮķāëÄ°Ņļ――üĩÄÉđâËاĩ―ÄĪÉÏĢŽëmČŧÉđâËØŪ(dĻĄng)rēŧŪa(chĻĢn)ÉúÎÓÎëxB(tĻĪi)ŅõĢŽĩŦĘĮËüūÖēŋ§(dĻĢo)ÖÂÄĪ―M·ÖÝpŌŨÆÆÄĄĢÔ·―·ĻĘĮÓÐČĪĩÄĢŽŌōéËüŋÉÄÜŪa(chĻĢn)ÉúÁËŌŧ·N·―·ĻW(xuĻĶ)ĢŽŅÐūŋÕßŋÉēÉÓÃÔ·―·ĻĶũßfĘžþÔÚrégšÍŋÕégÉÏßMÐÐŋØÖÆĢŽÔĘÔSËûrŅÐūŋÄģžČķĻ·ÖŨÓÔÚ°ûČ(nĻĻi)âķČÍŧČŧÔöžÓĩÄŨũÓÃĄĢ
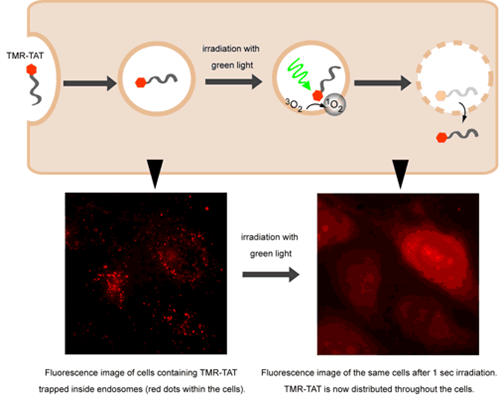
D 2 ŌŧĩĐÓÃūGđâÕÕÉäĢŽÉđâōüšÏÎïTMR-TATūÍÄČ(nĻĻi)šówá·ÅģöíĄĢ
ÎīíĩÄŅÐūŋ·―Ïō
ÔSķāî}ČÔÐčŌŠ―âQĢšß@ÐĐÔĐÔÚ·ÖŨÓËŪÆ―ÉÏĘĮČįšÎČÜ―âÄĪĩÄĢŋÔÚ°ûÍĖÍū―(jĻĐng)ß\ÝrąŧũßfĩÄīó·ÖŨÓ―ĩ―âáĢŋČÜ―âČ(nĻĻi)šówĩÄÉúĀíŨũÓÃĘĮĘēÃīĢŋ―âQß@ÐĐî}íĘđČ(nĻĻi)šówČÜ―âÔĐŧîÐÔß_ĩ―Ũî(yĻu)ũßflžþĄĢPelloisŅÐūŋ―MÄŋĮ°ŌēÔōËûĩÄ·―·ĻÓÃÓÚĶ°ŅÞD(zhuĻĢn)äŌōŨÓũßfĩ―ž°ûČ(nĻĻi)ĄĢŽF(xiĻĪn)ÔÚĩÄÄŋË(biĻĄo)ĘĮÖØÐÂūģĖšÍēŲŨũČËîž°ûŌÔŦ@ĩÃ―MŋÐÞÍ(fĻī)ĄĢŨîšóĢŽËûÕýēÉÓÃÄČ(nĻĻi)šówÁŅ―âŦ@ĩÃ―ĖÓ(xĻīn)íé_°l(fĻĄ)ÄÜÓÐЧÁŅ―âžūúÄĪĩÄķāëÄÔĐĄĢß@Ōŧ·―ÃæĢŽÄŋĩÄĘĮW(xuĻĶ)þČįšÎĒËĀžūúķøēŧĒËĀČËĩÄ―Ąŋĩž°ûĄĢ
ĒŋžÎÄŦI
1. Lee, Y. J.; Johnson, G.; Pellois, J. P. Biochemistry 2010, 49, 7854.
2. Lee, Y. J.; Erazo-Oliveras, A.; Pellois, J. P. Chembiochem 2010, 11, 325.
3. Angeles-Boza, A. M.; Erazo-Oliveras, A.; Lee, Y. J.; Pellois, J. P. Bioconjug Chem 2010, 21, 2164.
4. Srinivasan, D.; Muthukrishnan, N.; Johnson, G. A.; Erazo-Oliveras, A.; Lim, J.; Simanek, E. E.; Pellois, J. P. PLoS ONE 2011, 6, e17732.
íÔīĢšÉÏšĢĘĨŌŲŲQ(mĻĪo)ŌŨÓÐÏÞđŦËūÉúÎïát(yĻĐ)W(xuĻĶ)ēŋ
Â(liĻĒn)ÏĩëÔĢš13816095042
E-mailĢšlgl1983@sina.cn
Â(liĻĒn)ÏĩëÔĢš13816095042
E-mailĢšlgl1983@sina.cn
- ČŪÏŲēĄķūŋđÔzyŋĻĘđÓÃÕfÃũøĢĻÄzów―ð·ĻĢĐ
- ØÎÁēĄķūŋđÔzyŋĻĘđÓÃÕfÃũøĢĻÄzów―ð·ĻĢĐ
- Õýī_―âQELISAzy―Y(jiĻĶ)đûÆŊŌÆî}ĩÄÏī°å·―·Ļ
- Č(nĻĻi)ķūËØÏÞÖĩĩÄķĻÁxÅcÖØŌŠÐÔž°Č(nĻĻi)ķūËØÏÞÖĩĩÄÓËã·―·Ļ
- ·üņRķūËØB1zyÔĐšÐĘđÓÃÕfÃũø
- ĖæÃŨŋžÐĮzyÔĐšÐĘđÓÃÕfÃũø
- ―Y(jiĻĶ)ū§ŨÏzyÔĐšÐĢĻÃļÂ(liĻĒn)ÃâŌß·ĻĢĐĘđÓÃÕfÃũø
- žŨíŋÃđËØzyÔĐšÐĢĻÃļÂ(liĻĒn)ÃâŌß·ĻĢĐĘđÓÃÕfÃũø
- áÉúÉúÎïPCRzyÔĐšÐÏĩÁÐŪa(chĻĢn)Æ·ÖÐĮïĖØŧÝrČýÕÛÆð
- ŅÐÉúÍÆģöūdŅōÐĮ îēĄķūPCRzyÔĐšÐé_W(xuĻĶ)īŲäNŧîÓ
- ÃĀĩÂÂÍÆģöÐÂÆ·ÄXÄĪŅŨÄÎÉŠūúIgGŋđówzyÔĐšÐ
- ÃĀøËĩäļüÐÂĢš·ĮÓÎïÔīžūúČ(nĻĻi)ķūËØyÔžžÐg(shĻī)ÕýĘ―Ŧ@Åú
- ŌŨŲQ(mĻĪo)át(yĻĐ)ŊBIOWEEK2024ówÍâÔ\āÏĩÁÐþŨhAMÂäÄŧĢĄ
- I-O Asia 2024ÖÞÄ[ÁöÔ\ŊÅcËÎï(chuĻĪng)зåþÍĻÖŠ
- ÐĄšĢý°l(fĻĄ)ēž28ÖØšôÎüĩĀēĄÔówzyÔĐšÐ
- ÉúÎïÖÆÆ·Ų|(zhĻŽ)ÁŋŋØÖÆÖŪđĪËësŲ|(zhĻŽ)ÅcžķČzyŅÐÓþŅûÕ
Copyright(C) 1998-2024 ÉúÎïÆũēÄūW(wĻĢng) ëÔĢš021-64166852;13621656896 E-mailĢšinfo@bio-equip.com